
近日,“张江mRNA国际创新中心”共建单位蓝鹊生物在预印版上提交了题为“Dual Ethanolamine Head Groups in Ionizable Lipids Facilitate Phospholipid-free Stable Nanoparticle Formulation for Augmented and Safer mRNA Delivery”的论文。文章表明,蓝鹊生物已成功开发了一类创新可电离脂质,这类可电离脂质具有两个乙醇胺头基团,极大地增强了与mRNA分子的结合能力;同时,基于该类新分子,蓝鹊生物开发出一款全新的三组分递送配方,并命名其为iPLX。
非常值得关注的是,iPLX在多方面展示了优异的递送特性。
iPLX配方在中性pH条件下即可完成mRNA包封并形成脂纳米颗粒,而不必采用LNP所需的酸性包封环境,这得益于这类新脂质分子与mRNA之间更强的非离子键作用。
iPLX纳米颗粒展现了优异的颗粒稳定性和mRNA包封效率,并保持了高效的递送效能;同时,得益于磷脂组分的去除,iPLX还解决了传统LNP纳米颗粒常见的“冒泡”问题。
iPLX具有优异的递送效率和安全性;用其作为递送的mRNA疫苗可以诱发出显著的体液和细胞免疫;同时与现有的LNP递送系统相比,iPLX对系统性炎症因子的诱导也显著降低,进一步提高了疫苗的安全性。
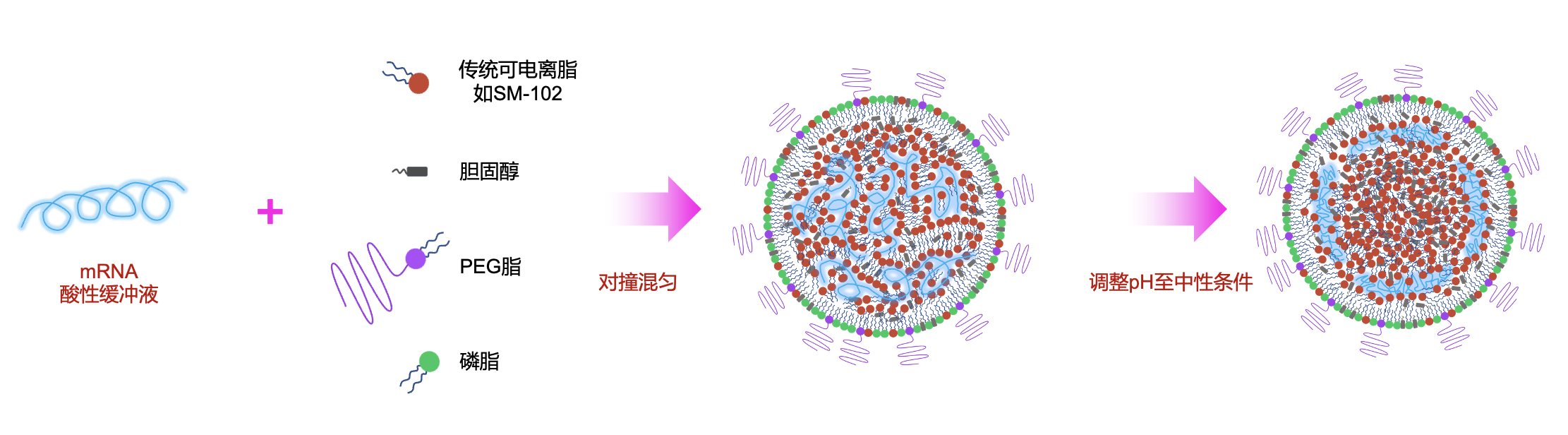
目前,mRNA疫苗最常用的仍是脂质纳米颗粒(LNP)递送系统。LNP包含四个必要组分:可电离脂、磷脂、胆固醇和PEG脂质。其中,可电离脂的优化是研究焦点,多种受专利保护的分子已被开发;除了可电离脂,四种成分的比例即所谓的配方也受到专利的严格保护。按照现有模型,LNP的形成始于可电离脂在酸性条件下与mRNA的相互作用,主要是因为在酸性条件下可电离脂质呈正电,与带负电的mRNA之间产生离子静电吸引力。这种相互作用形成一个mRNA-脂核心,再诱导胆固醇、磷脂和PEG脂质的聚集,直至PEG脂质在表面的积累抑制了纳米颗粒的进一步生长。包封后,LNP需要更换至中性缓冲液,目前普遍认为pH值的变化会显著改变颗粒的内部结构。这是因为pH升高后,可电离脂质失去正电荷,其与mRNA的相互作用减弱,导致可电离脂自我聚集并形成一个类似油滴的分离相。这种结构调整将mRNA推向LNP的外壳附近,此时,位于外壳上的磷脂对保持mRNA的封装至关重要。当采用DSPC做为磷脂组份时,LNP还面临另一个挑战-DSPC磷脂有很强的倾向形成脂质双层结构。因此,LNP在受到压力扰动或长期储存下DSPC会重排而在LNP表明长出泡状结构,此时mRNA也会释放到泡状空间。有趣的是,当把pH值调回酸性,可电离脂质重新获得正电荷时,mRNA会被重新吸收到脂质核中。这种动态过程突显了离子静电相互作用在维持LNP稳定性中的关键作用。
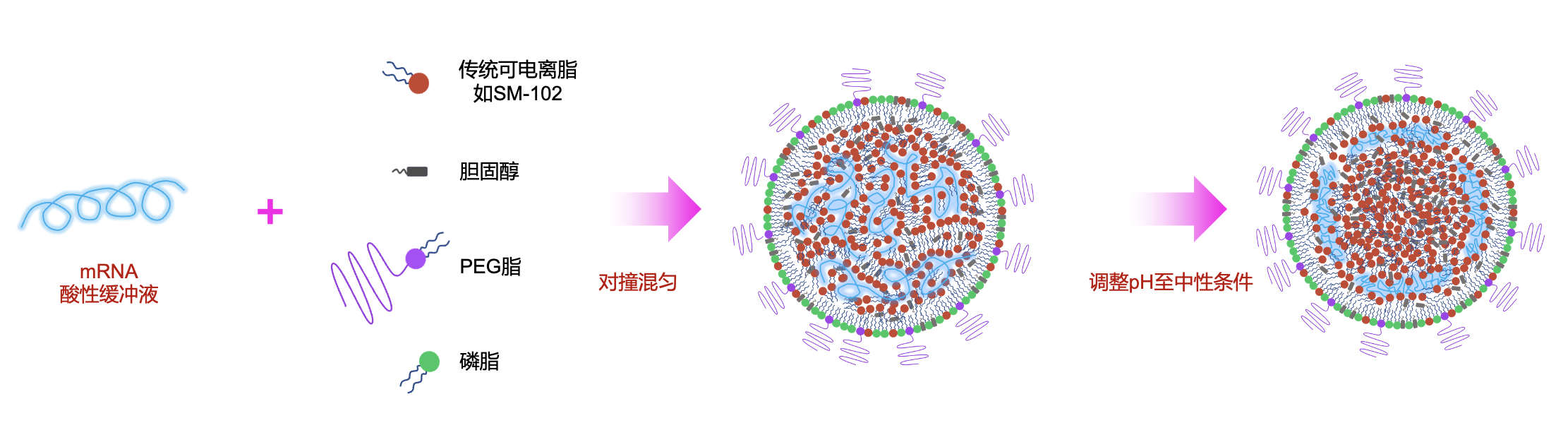
传统的mRNA-LNP结构及形成过程
近年来,为了提升LNP的靶向或者效率,其组分也愈发复杂,而给LNP做减法一直是递送领域的难点。如何在简化组份的同时维持纳米颗粒的稳定性和递送效率具有很大的挑战性。蓝鹊团队正通过引入双乙醇胺头基团来增强可电离脂和mRNA的相互作用,从而提高脂质纳米颗粒的稳定性。以先导化合物LQ-3为例,在使用传统配方比例时,LQ-3纳米颗粒的整体mRNA递送效率与具有单个乙醇胺头基团的脂质如SM-102相当。但在研究人员进一步优化纳米颗粒配方时,发现了一个有趣的现象,通常被认为起稳定作用的磷脂成分和LQ-3并不相容: 磷脂的引入不仅降低了LQ-3的递送效率,还降低了脂质纳米颗粒的稳定性。由于两种脂质尾部结构类似,这种差异可能是由于头部与mRNA的相互作用能力的差异造成的。研究人员测试了在酸性和中性条件下,将LQ-3和SM-102分别和mRNA直接混合,发现SM-102即使在酸性条件下也只能保护约50%的mRNA, 而LQ-3无论在酸性或中性条件下都能保护多达95%以上的mRNA,说明LQ-3分子具有超强的结合mRNA的能力,而且这种结合很大程度上依赖非离子类的相互作用。利用分子动力学模拟也验证了这一发现,LQ-3和mRNA形成了众多的氢键和范德华力相互作用,将mRNA吸附到脂球表面。
有了这个发现,研究人员在中性条件下测试了LQ-3、胆固醇和PEG脂包三组份包封mRNA形成纳米颗粒的能力,发现与酸性条件的混合包封没有区别。这意味着在纳米颗粒生产过程中,无需进行pH的调整,从而避免了LNP在pH转换过程中的聚集问题。
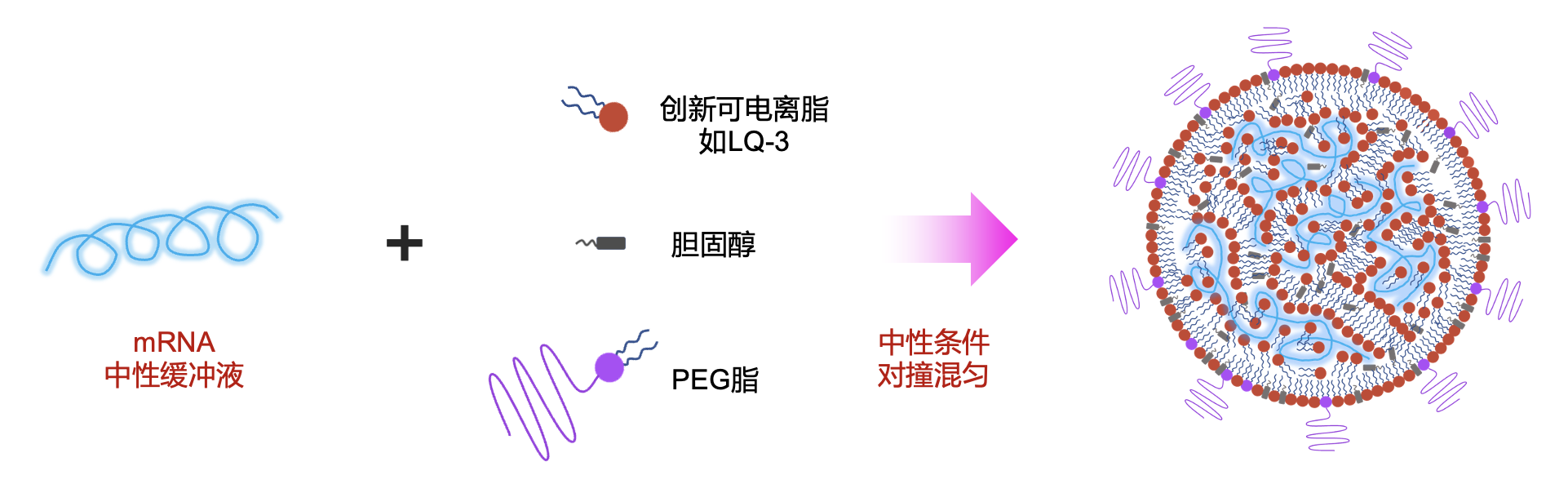
mRNA-iPLX结构与形成过程
对于SM-102类阳离子脂质,磷脂成分不可或缺,对维持LNP的稳定结构非常重要。在不含磷脂的情况下,SM-102形成的颗粒非常脆弱,一次冻融即发生崩解,导致mRNA的释放。而LQ-3仅需胆固醇的辅助即可形成超稳定颗粒,引入磷脂,反而影响了纳米颗粒的稳定性,导致颗粒均匀度变差。这种配方有点类似传统的lipoplex递送系统。在lipoplex里,使用带永久正电荷的阳离子脂质,通过强离子相互作用和核酸形成复合物,因此只需加入一种辅助脂质即可形成稳定颗粒。而LQ-3的非离子静电相互作用同样能与mRNA形成稳定复合物,因此只需胆固醇即可。为区别传统的四组分LNP配方,蓝鹊生物将新型脂纳米颗粒命名为iPLX。
蓝鹊生物进一步研究了用iPLX递送系统开发mRNA疫苗的潜力。以多价新冠mRNA疫苗为例,LQ-3 iPLX和SM-102 LNP展现出同等的诱导体液免疫和细胞免疫的能力,同时毒理研究表明,LQ-3 iPLX诱导的系统性炎症因子IL-6和TNF-α显著弱于SM-102 LNP,这有望进一步提高mRNA疫苗的安全性。
蓝鹊生物的这项发现对我国mRNA疫苗具有重要的发展意义。三组分iPLX递送系统的发现表明,可以通过调节离子化脂质和mRNA之间的非离子相互作用,呈现与现有理解的范式显著不同的脂质纳米颗粒形成动力学,为mRNA递送系统领域内的脂质优化提供了新的方向。同时,iPLX在脂质分子结构和配方上都有效的规避了现行脂质递送专利,实现了mRNA递送领域真正意义上的底层突破。这项成果是张江mRNA国际创新中心平台建设和技术创新的一项重要成果,将为中国自主创新的mRNA平台建设和发展奠定了坚实的基础。
原文链接:https://biorxiv.org/cgi/content/short/2023.10.13.562139v1

张江mRNA国际创新中心
张江mRNA国际创新中心(以下简称“中心”)是在上海推进科技创新中心建设办公室规划下,复旦大学牵头建设,和上海蓝鹊生物等mRNA技术领先企业强强联合,凝聚长三角地区高校、科研院所的优势学科和科研资源,携手上海及国内mRNA优势企业,共同打造开放共享、世界一流的mRNA药物研发技术平台与公共服务平台。中心将助力基础研究到临床转化的无缝链接,为mRNA区域和产业发展提供源头技术供给,为mRNA创新型中小企业孵化、培育和发展提供技术支撑与创新服务。
中心的建立有望快速弥补我国mRNA基础研究的不足,突破制约我国mRNA产业安全的关键技术瓶颈,为mRNA药物和疫苗开发研究提供重要平台。我们将积极推进产学研联盟建设,集合各高校、科研单位、药物研发企业、制药技术服务企业、产业化制药公司等多方力量,促进mRNA的技术创新及成果转化,加快推进mRNA药物的研发和产业化,将中心打造成集人才培养、技术创新、资源汇聚及临床应用的mRNA药物研发平台。